





Regla del Octeto
Establece que los átomos de los elementos se enlazan unos a otros en el intento de completar su capa de valencia.
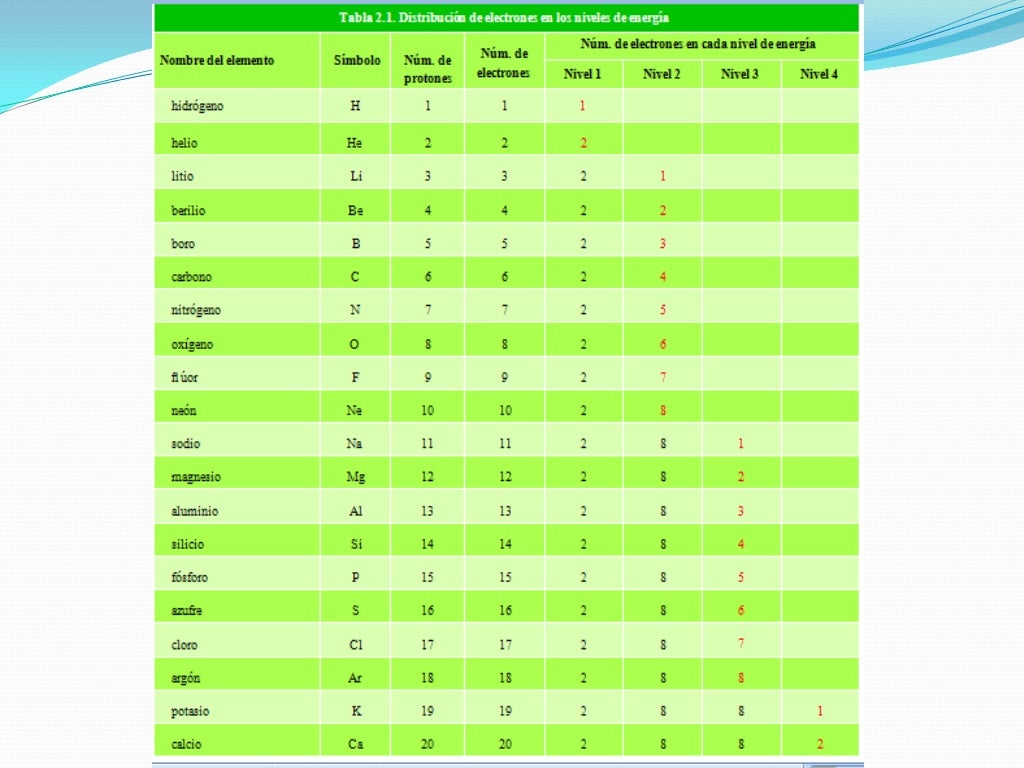
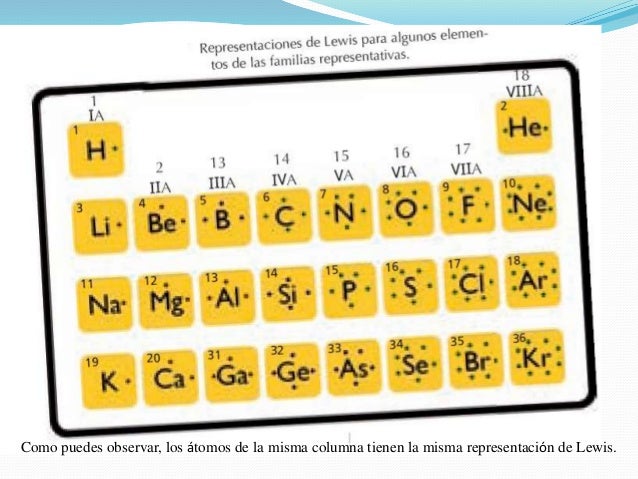
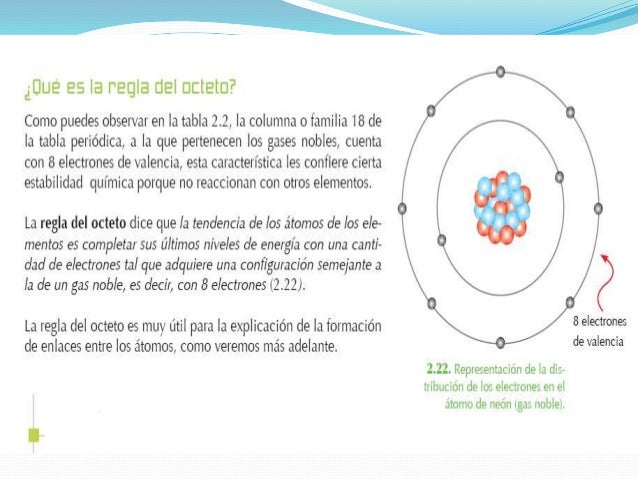
La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones.
Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia.
Regla de Dueto
Cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones de modo que el último nivel de energía de cada átomo contenga 8 electrones y así adquiera la configuración electrónica del gas noble más cercano en la tabla periódica.
En el caso de los átomos de los elementos H, Li y Be, cuando establecen enlaces, tienden a completar su último nivel de energía con 2 electrones y alcanzar la configuración electrónica del gas noble helio (He). (Regla del dueto)
-Los elementos metálicos ceden electrones.
-Los elementos no metálicos ganan o comparten electrones.
Clasificación del enlace químico
Aquí un vídeo explicado:




No hay comentarios:
Publicar un comentario