Fórmulas de Lewis para moléculas e iones poliatómicos.
Las formulas de Lewis las usamos para mostrar los electrones de valencia en dos moléculas simples. Una molécula de agua puede representarse por uno de los siguientes diagramas.

Una molécula de H2O tiene dos pares electrónicos compartidos, es decir, dos enlaces covalentes simples. El átomo O tiene dos pares no compartidos:
En las formulas de guiones, un par de electrones compartidos se indican por un guión. En el dióxido de carbono (CO2) hay dos dobles enlaces, y su formula de Lewis es:
En las formulas de guiones, un par de electrones compartidos se indican por un guión. En el dióxido de carbono (CO2) hay dos dobles enlaces, y su formula de Lewis es:
Una molécula de dióxido de carbono (CO2) tiene cuatro pares electrónicos compartidos, es decir, dos dobles enlaces. El átomo central (C) no tienes pares sin compartir.
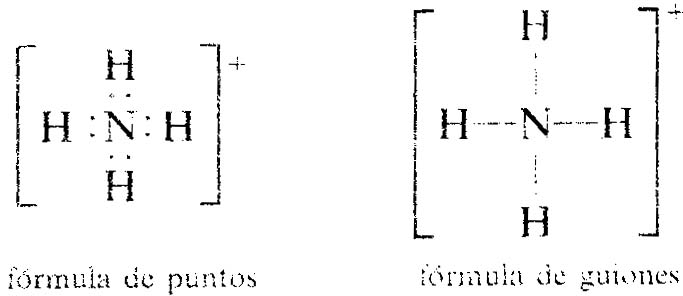
Los enlaces covalentes en un ion poliatómico pueden representarse de la misma forma. La formula Lewis para el ion amonio, NH4, muestra solo ocho electrones, aunque el átomo N tiene cinco electrones en su capa de valencia y cada átomo H tiene uno, con un total de cinco más cuatro (1) igual nueve electrones. El ion NH4+, con una carga de 1+, tienen un electrón menos que los átomo originales.
Los enlaces covalentes en un ion poliatómico pueden representarse de la misma forma. La formula Lewis para el ion amonio, NH4, muestra solo ocho electrones, aunque el átomo N tiene cinco electrones en su capa de valencia y cada átomo H tiene uno, con un total de cinco más cuatro (1) igual nueve electrones. El ion NH4+, con una carga de 1+, tienen un electrón menos que los átomo originales.
Describir formulas de Lewis es un método de contar los electrones que es útil para la primera aproximación para sugerir esquemas de enlaces. Es importante saber que las formulas de puntos de Lewis solo muestran el número de electrones de valencia, el número y las clases de enlaces y el orden en que están conectados los átomos. No intentan mostrar las formas tridimensionales de las moléculas e iones poliatómicos.
Regla del Octeto. Limitaciones de la regla del octeto para la formula de Lewis.
Regla de octeto. Se basa en que un átomo diferente del hidrógeno tienden a formar enlaces hasta que se rodea de ocho electrones de valencia, es decir, un enlace covalente se forma cuando no hay suficientes electrones para que cada átomo individual tenga el octeto completo. Al compartir electrones en un enlace covalente, los átomos individuales pueden completar sus octetos.
La regla del octeto funciona principalmente para los elementos del segundo periodo de la tabla periódica. Estos elementos solo tienen subniveles 2s 2p, los cuales pueden contener un total de ocho electrones. Cuando un átomo de uno de estos elementos forman un compuesto covalente, pueden obtener la configuración electrónica de gas noble [Ne] al compartir electrones con otros átomos del mismo compuesto.
Regla de octeto. Se basa en que un átomo diferente del hidrógeno tienden a formar enlaces hasta que se rodea de ocho electrones de valencia, es decir, un enlace covalente se forma cuando no hay suficientes electrones para que cada átomo individual tenga el octeto completo. Al compartir electrones en un enlace covalente, los átomos individuales pueden completar sus octetos.
La regla del octeto funciona principalmente para los elementos del segundo periodo de la tabla periódica. Estos elementos solo tienen subniveles 2s 2p, los cuales pueden contener un total de ocho electrones. Cuando un átomo de uno de estos elementos forman un compuesto covalente, pueden obtener la configuración electrónica de gas noble [Ne] al compartir electrones con otros átomos del mismo compuesto.
Limitaciones del las reglas de octeto para las formulas de Lewis.
Las formulas de Lewis normalmente no se escriben para compuestos que contienen metales de transición d y f. los metales de transición d y f utilizan en el enlace orbítales s y p.
1.- La mayoría de los compuestos covalentes del berilio, Be. Debido a que Be contiene solo dos electrones en la capa de valencia, habitualmente forma solo dos enlaces covalentes cuando se enlaza con otros dos átomos. Por lo tanto se usa cuatro electrones como el número necesario para Be en la etapa 2, en la etapa 5 y 6 se usa solo dos pares de electrones para Be.
2.- La mayoría de los compuestos covalentes de los elementos del Grupo IIIA, especialmente boro, B. Estos elementos contienen solo tres electrones en la capa de valencia, así que a menudo forman tres enlaces covalentes cuando se enlazan a otros tres átomos. Por lo tanto, se usa seis electrones como el número necesario para los elementos IIIA contiene solo tres electrones en la etapa 2; y en las etapas 5 y 6 se usa solo tres pares de electrones para los elementos IIIA.
3.- Los compuestos o iones que contienen un número impar de electrones ejemplos son NO, con 11 electrones en la capa de valencia, y NO2, con 17 electrones en la capa de valencia.
4.- Compuestos o iones en los que el elemento central necesita más de ocho electrones en la capa de valencia para mantener todos los electrones disponibles, D. cuando uno se encuentra con esto, se añaden las reglas extra a las etapas 4 y 6.
Etapa 4a: si C, el numero de electrones compartidos, es menor que el número necesario para enlazar todos los átomos al átomo central, entonces C se aumenta el número de electrones necesario.
Etapa 6a: si C debe aumentarse en la etapa 4a, entonces los octetos de todos los átomos podrían satisfacerse antes de que todos los electrones D hayan sido añadidos. Colocar los electrones extra sobre el elemento central.
Muchas veces que violan las reglas del octeto son muy reactivas por ejemplo, los compuestos que contienen átomos con solo cuatro electrones de valencia (limitación 1 de arriba) o seis electrones de valencia (limitación 2 de arriba) frecuentemente reaccionan con otras especies que suministran pares electrónicos. Compuestos como estos que aceptan un par de electrones para compartir se denominan ácido de Lewis: una base le Lewis es una especie que puede disponer de un par de electrones para compartir. Las moléculas con un número impar de electrones a menudo se dimerizan (combinan en pares) para dar productos que sí satisfacen la regla de octeto, ejemplos son la dimerización del NO para formar N2O2 y del NO2 para formar N2O4.
Las formulas de Lewis normalmente no se escriben para compuestos que contienen metales de transición d y f. los metales de transición d y f utilizan en el enlace orbítales s y p.
1.- La mayoría de los compuestos covalentes del berilio, Be. Debido a que Be contiene solo dos electrones en la capa de valencia, habitualmente forma solo dos enlaces covalentes cuando se enlaza con otros dos átomos. Por lo tanto se usa cuatro electrones como el número necesario para Be en la etapa 2, en la etapa 5 y 6 se usa solo dos pares de electrones para Be.
2.- La mayoría de los compuestos covalentes de los elementos del Grupo IIIA, especialmente boro, B. Estos elementos contienen solo tres electrones en la capa de valencia, así que a menudo forman tres enlaces covalentes cuando se enlazan a otros tres átomos. Por lo tanto, se usa seis electrones como el número necesario para los elementos IIIA contiene solo tres electrones en la etapa 2; y en las etapas 5 y 6 se usa solo tres pares de electrones para los elementos IIIA.
3.- Los compuestos o iones que contienen un número impar de electrones ejemplos son NO, con 11 electrones en la capa de valencia, y NO2, con 17 electrones en la capa de valencia.
4.- Compuestos o iones en los que el elemento central necesita más de ocho electrones en la capa de valencia para mantener todos los electrones disponibles, D. cuando uno se encuentra con esto, se añaden las reglas extra a las etapas 4 y 6.
Etapa 4a: si C, el numero de electrones compartidos, es menor que el número necesario para enlazar todos los átomos al átomo central, entonces C se aumenta el número de electrones necesario.
Etapa 6a: si C debe aumentarse en la etapa 4a, entonces los octetos de todos los átomos podrían satisfacerse antes de que todos los electrones D hayan sido añadidos. Colocar los electrones extra sobre el elemento central.
Muchas veces que violan las reglas del octeto son muy reactivas por ejemplo, los compuestos que contienen átomos con solo cuatro electrones de valencia (limitación 1 de arriba) o seis electrones de valencia (limitación 2 de arriba) frecuentemente reaccionan con otras especies que suministran pares electrónicos. Compuestos como estos que aceptan un par de electrones para compartir se denominan ácido de Lewis: una base le Lewis es una especie que puede disponer de un par de electrones para compartir. Las moléculas con un número impar de electrones a menudo se dimerizan (combinan en pares) para dar productos que sí satisfacen la regla de octeto, ejemplos son la dimerización del NO para formar N2O2 y del NO2 para formar N2O4.
Info basada de este sitio web
Leer más: http://www.monografias.com/trabajos12/quimi/quimi.shtml#fo#ixzz3sfKWMx2x
Ejemplos de IONES CON LAS ESTRUCTURAS DE LEWIS
Ejemplos de CLASIFICACIÓN DEL ENLACE COVALENTE
Vídeo Explicado:
No hay comentarios:
Publicar un comentario